- 주경준 기자
- 승인 2022.07.14 06:04
바이오시밀러 36품목이 FDA 승인이 되는 동안 품목의 3배가 넘는 111건의 특허무효심판(IPR) 신청이 제기됐다. 말 그대로 특허 다툼의 연속이었다.
그러나 2017년 56건에 달하며 정점을 찍었던 IPR(Inter Partes Review) 신청은 2020년 1건, 지난해 2건으로 급감했으며 올해에는 현재까지(회계년도 10월~9월)단 한 건도 없었다.
미국의 다국적 로펌 모건 루이스&보키우스는 최근 발표한 '블록버스트 생물학제제생산자 분기 검토보고서'를 통해 바이오시밀러 출시관련 참조품목 보유사와 펼쳐진 특허무효심판 분석자료를 공개했다.
먼저 바이오시밀러 36품목이 FDA 승인을 받고 현재까지 22품목이 시판되는 과정에서 IPR은 모두 91건 진행했다.
특허무효심판(이하 IPR)은 특허침해 소송으로 시밀러 출시 제약사가 피소될 경우 미국 특허청내 특허심판원(PTAB; Patent Trial & Appeal Board)에 제기하는 특허무효심판의 하나다.
무효심판을 제기해 실제 사건의 성립, 심사와 최종결정까지 진행된 비율은 37%였다. 이는 IPR 신청 이후 중단 또는 합의, 병행 진행된 다른 소송 등의 영향으로 특허문제가 해결된 수치는 제외된 비율이다.
특허심판원의 최종 결정이 내려진 43%(42건중 18건)가 특허무효 결정을 받았다. 이중 60%는 부분 무효 결정이었다.
IPR 신청이 가장 많았던 참조 품목은 허셉틴 36건, 리툭산 27건, 휴미라 22건, 뉴라스타 8건 순이다.
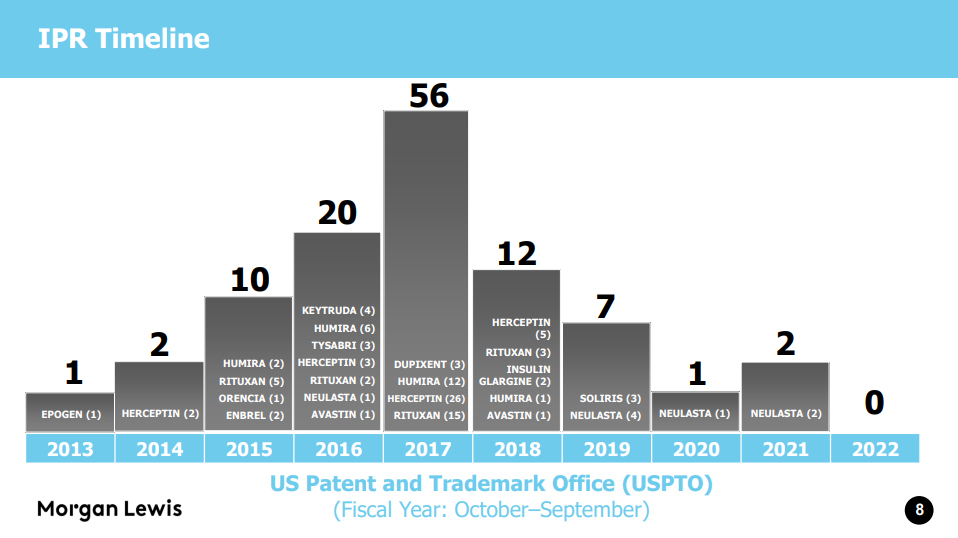
참고로 2020년 이후 IPR 신청건은 총 3건으로 모두 뉴라스타 건이다. 지난 4월 순회 고등(항소)법원이 특허심판원(PTAB)의 IPR 특허무효 결정에 대해 정면 반하는 판결로 특허다툼의 혼란이 커지기도 했다.
특허무효심판 신청 건수가 낮아졌다는 것은 오리지널 참조제품 제약사와 바이오시밀러 출시 제약사간은 특허다툼이 2017년을 정점으로 줄어들고 있는 것으로 미뤄 해석됐다. 또 맞소송 등 시밀러 제약사의 대응전략의 변화도 '애비브 대 알보텍' 사례 등을 통해 확인 가능했다.
보고서는 또 6월말 현재 기준 미국의 바이오시밀러 출시 현황에 대한 분석 자료도 제공하고 있다.
또한 미국 바이오시밀러의 35품목의 FDA 승인까지 평균 소요기간, 출시된 22품목의 평균 출시까지 기한 등이 분석됐다.
36품목의 FDA 신청후 승인까지 기간은 평균 515.6일로 1년 5개월이 넘게 걸렸다. 시판 22품목의 승인신청 후 시판까지 걸린 날자는 774.4일로 2년을 넘겼다. FDA 승인 후 시판까지는 평균 246.4일이 걸렸다.
통상 참조제품 제약사와의 소송. 출시일 합의 등이 바이오시밀러의 출시를 늦추는 요인으로 판단된다.
이외 보고서는 2023년 순차 출시될 휴미라 바이오시밀러의 경우 FDA 승인된 7품목 이외 추가경쟁 가세 3품목까지 애브비와 협의된 미국시장 출시일자도 함께 정리, 공개됐다.
美시밀러 36품목 특허무효심판 111건...올해는 전무 - 뉴스더보이스헬스케어 (newsthevoice.com)
'제약세상' 카테고리의 다른 글
| 韓제약바이오, 해외 진출을 위해 필요한 기본요소는? (0) | 2022.07.18 |
|---|---|
| PD-1 6품목 연속 FDA승인 수난사...티스렐리주맙 승인연기 (0) | 2022.07.15 |
| "졸겐스마주, 이달 건정심서 심의...RSA 유형 3~4개 반영" (0) | 2022.07.14 |
| '선택과 집중' 사노피, 뉴락스파마에 17품목 매각 (0) | 2022.07.13 |
| 한미 포지오티닙, EGFR 엑손20 변이 폐암 효과 입증 (0) | 2022.07.13 |