- 최은택 기자
- 승인 2022.07.12 06:43
"형평성 등 고려해야"...식약처에 개선 권고

규제당국이 임상시험 정기 안전성 보고 의무 위반에 대한 행정처분(안) 수위가 같은 법령 내 유사사례와 비교해 과도한 측면이 있다면서 수위를 조절하도록 개선 권고했다.
규제개혁위원회는 식품의약품안저처가 제출한 '의약품 등의 안전에 관한 규칙 개정안'에 대한 안건심의 내용을 최근 공개했다.
11일 공개내용을 보면, 규개위는 개정안에 대해 심의한 결과 동일 법령 내 유사 사례와의 형평성, 피규제자 부담 등을 고려해 당초 개정안보다 행정처분 수준을 완화하도록 개선 권고했다.
식약처 개정안은 임상시험 정기 안전성 보고와 관련, '임상시험용의약품 정기안전성 보고서 미체출'과 '시판 1개월 전 위해성 관리 계획 미제출(시판 후 1개월 이내 제출, 시판 후 1개월 이후 제출 또는 미제출)'로 나눠 위반횟수에 따라 행정처분을 신설하는 내용이 골자다.
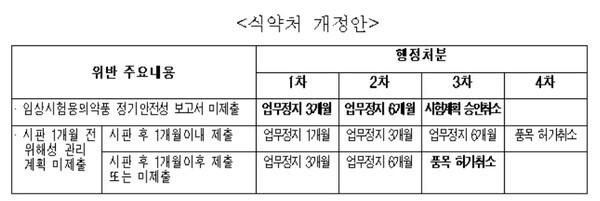
먼저 '임상시험용의약품 정기안전성 보고서 미제출'의 경우 위반 시 1차 업무정지 3개월, 2차 6개월, 3차 시험계획 승인취소로 처분수위를 설정했다.
이에 대해 규개위는 1차 경고, 2차 업무정지 1개월, 3차 3개월, 4차 6개월로 처분수위를 완화하라고 개선 권고했다.
시판 1개월 전까지 위해성 관리계획을 제출하지 않았다가 시판 후 1개월 이내 제출한 경우 당초 식약처 처분안은 1차 업무정지 1개월, 2차 3개월, 3차 6개월, 4차 품목 허가취소였다. 또 '시판 후 1개월 이후 제출 또는 미제출'에 대해서는 1차 업무정지 3개월, 2차 6개월, 3차 품목 허가취소로 처분수위를 더 높였다.
이에 대해 규개위는 시판 후 제출기간 또는 제출유무 구분 없이 시판 1개월 전까지 위행성 관리 계획을 제출하지 않은 경우 1차 업무정지 3개월, 2차 6개월, 3차 9개월, 4차 품목 허가취소로 조정하라고 개선 권고했다.
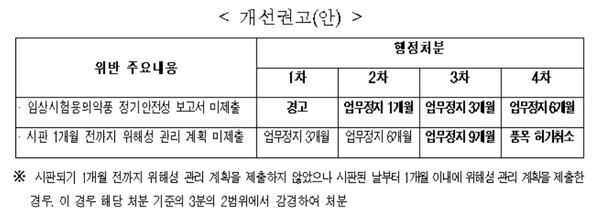
또 시판되기 1개월 전까지 위해성 관리 계획을 제출하지 않았으나 시판된 날부터 1개월 이내에 위해성 관리 계획을 제출한 경우 해당 처분 기준의 3분의 2범위에서 감경해 처분하도록 했다.
이와 관련 규개위 한 위원은 "의약품의 안전관리는 국민건강에 미치는 영향을 고려할 때 철저한 관리가 필요하나 유사입법례 비교, 내용의 위험성 등을 고려해 행정처분 기준을 완화할 필요가 있다"고 했다.
규개위 "임상시험 안전성 보고의무 위반 처분수위 완화하라" - 뉴스더보이스헬스케어 (newsthevoice.com)
'제약세상' 카테고리의 다른 글
| 한미 포지오티닙, EGFR 엑손20 변이 폐암 효과 입증 (0) | 2022.07.13 |
|---|---|
| '필러'시술 약사 허용...스코틀랜드, 약국 '클리닉'에 포함 추진 (0) | 2022.07.12 |
| 제약사 못믿어...CA 주정부 인슐린 직접 생산 결정 (0) | 2022.07.11 |
| [It's Original]⑮ 항응고제(혈액응고저지제) '릭시아나' (0) | 2022.07.11 |
| 제네릭 시장점유율, 네덜란드81.1%, 독일 78.7%순 (0) | 2022.07.08 |