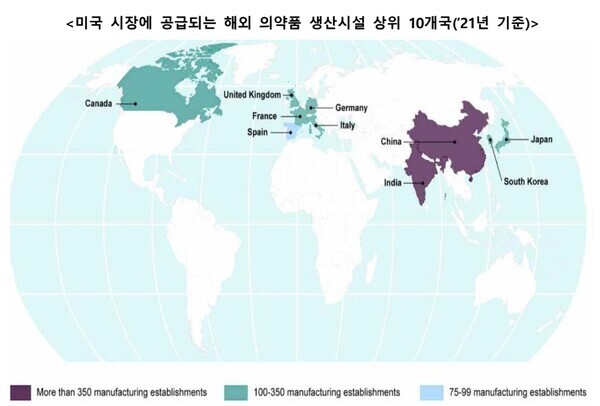
문윤희 기자/ 승인 2023.01.18 06:59 상반기 내 실사 가능성 높아져…재료·품질관리·생산·설비 관련 재검점 미국 바이든 행정부가 서명한 2023년 통합세출법(onsolidated Appropriations Act of 2023)에 따른 FDA 현지 실사가 올해 본격적으로 추진될 전망이어서 관련 업계의 준비가 필요할 것으로 보인다. 한국은 아시아 주요 국가로 선정한 인도, 중국, 일본을 비롯해 영국, 프랑스, 독일, 이탈리아, 스페인, 캐나다 등 주요 10개국에 포함돼 있다. 이들 국가는 올해 시행되는 파일롯 프로그램과 사전 예고 없이 진행되는 상시적으로 진행되는 실사를 받을 것으로 예측되고 있다. 관련해 한국바이오협회는 17일 'FDA, 해외 의약품 생산시설 불시 점검 추진'을 주제로 한 보고..